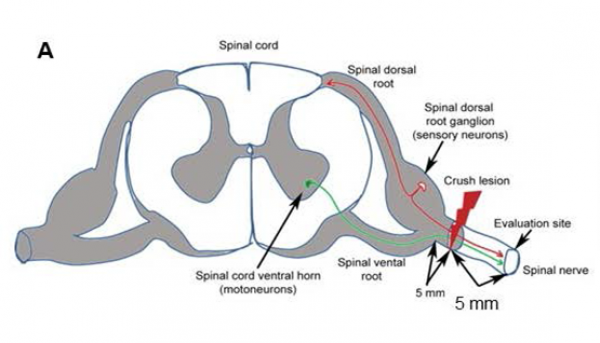
Schematic illustration of the surgical procedures. Crush lesion of sensory fibers (red) and motor fibers (green) in a cervical nerve between levels C6 and C7. The crush injury is performed 5 mm distal to the DRG. The regeneration of sensory and motor axons is evaluated at 5 mm from the lesion site (evaluation site).
Les terpénoïdes, dont fait partie de squalène, sont un groupe de composés naturels qui sont particulièrement diversifiés en ce qui concerne leur structure et leur fonction. Notre objectif est d'utiliser l'extraordinaire capacité d'auto-assemblage de dérivés squaléniques en milieu aqueux sous forme de nanoparticules pour la nanoformulation de macromolécules (siRNA pour Small Interfering RNA) ou de petites molécules (adénosine) dans le but d’évaluer leurs efficacités dans le traitement de deux affections du système nerveux périphérique:
- la maladie de Charcot-Marie-Tooth de type 1A (CMT-1A), une neuropathie périphérique héréditaire sensitivomotrice, dont la transmission est autosomique dominante causée par une duplication d'un ou de deux allèles du gène codant pour la protéine périphérique de la myéline PMP22;
- la lésion du plexus brachial, un traumatisme fréquemment trouvé après des accidents de la circulation chez les adultes ou une distorsion de l'épaule chez les nouveaux nés.
Actuellement, il n'existe que des traitements palliatifs et symptomatiques pour les patients CMT-1A et aucun médicament n'est actuellement disponible pour ralentir ou arrêter la progression de cette maladie. En ce qui concerne les lésions du plexus brachial, la reconstruction des racines nerveuses endommagées pour restaurer les fonctions sensorielles est uniquement basée sur la chirurgie. Les options pharmacologiques manquent pour protéger les neurones et favoriser la repousse axonale.
Le but de notre projet est d’introduire une nouvelle nanomédecine basée sur l’utilisation des molécules squalénées. Des siRNA dirigés contre le gène PMP22 seront utilisés pour restaurer son expression dans la maladie CMT-1A ; l’adénosine pour réparer les lésions du plexus brachial.
Dans cet objectif 4 équipes du LabEx NanoSaclay se sont regroupées pour proposer ce programme de recherche qui consistera à :
- évaluer in vitro des séquences de siRNA,
- coupler les siRNA et l'adénosine au squalène,
- caractériser la structure des nanoparticules,
- évaluer l’internalisation des nanoparticules,
- évaluer le comportement pharmacologique de ces nanomédicaments (toxicité systémique et la pharmacocinétique) ainsi que leurs efficacités dans des modèles animaux.
Ces travaux bénéficieront aussi de l’expertise de deux partenaires externes au LabEx NanoSaclay qui sont spécialisés dans les maladies neurologiques: Michael Schumacher, U1195 Inserm et Université Paris-Sud et Charbel Massaad, UMR INSERM S_1124, Université Paris Descartes.
Pour résumer, ce projet interdisciplinaire ouvre des perspectives thérapeutiques pour deux maladies neurologiques sans traitement efficace à l’heure actuelle : la maladie de Charcot-Marie-Tooth 1A et les lésions du plexus brachial. En cas de succès, il aura certainement des chances concrètes pour atteindre le développement industriel avec des applications en clinique.
Contact : , CNRS UMR 8203, Equipe: New anticancer therapies.
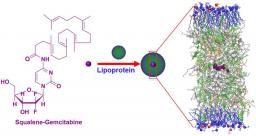
Dans un article publié dans la revue Nature Communications, l’équipe de Patrick Couvreur à l’Institut Galien a découvert qu’il était possible d’exploiter les lipoprotéines (LDL, HDL) de la circulation générale pour la vectorisation indirecte de médicaments, à condition que ceux-ci soient équipés d’un groupement chimique ayant une forte affinité pour les LDL.
La preuve de concept de cette approche a été démontrée par le couplage chimique de différentes molécules pharmacologiquement actives au squalène, un lipide naturel et biocompatible, qui entraîne l’auto-assemblage des bioconjugués ainsi obtenus sous forme de nanoparticules. En utilisant comme modèle des nanoparticules de squalène couplé à la gemcitabine (un anticancéreux majeur), il a été montré, in vitro sur sang complet humain et in vivo chez l’animal, que les bioconjugués de gemcitabine-squalène étaient rapidement captés par les lipoprotéines circulantes (LDL chez l’homme et HDL chez le rongeur) après désagrégation des nanoparticules dans la circulation générale. L’interaction entre les nanoparticules squalénées et les LDL peut être imaginée comme un processus dynamique qui implique l’adsorption des petites particules de LDL (22 nm) à la surface des nanoparticules (120 nm) dès qu’elles entrent en contact les unes avec les autres, comme cela a été montré en microscopie électronique à transmission. Cette interaction a également été confirmée à l’échelle moléculaire par des méthodes calorimétriques d’interaction (ITC) ainsi que par de la modélisation moléculaire. Ces résultats expliquent la pharmacocinétique prolongée de la gemcitabine-squalène après administration intraveineuse, contrairement à la gemcitabine libre, qui n’interagissant pas avec les lipoprotéines plasmatiques, a une clairance plasmatique très rapide.
Comme la capture des LDL est fortement augmentée dans les cellules néoplasiques en division, l’approche suivie peut avoir des implications importantes pour le traitement du cancer. En provoquant l’insertion de médicaments in situ, directement dans les LDL circulants, la stratégie de “squalénisation” a pu résoudre ce problème et proposer le nouveau concept de “vectorisation indirecte” de médicaments.
Référence: Conjugation of squalene to gemcitabine as unique approach exploiting endogenous lipoproteins for drug delivery
Sobot D, Mura S, Yesylevsky S, Dalbin L, Cayre F, Bort G, Mougin J, Desmaele D, Lepetre-Mouelhi S, Pieters G, Andreiuk B, Klymchenko A, Paul J-L, Ramseyer C, Couvreur P
Nature Communications 8, 15678 (2017)
Contact NanoSaclay: Patrick Couvreur
Collaborations:
- Département de physique des systèmes biologiques, Institut de Physique de l'Académie Nationale des Sciences d'Ukraine
- CEA Saclay, iBiTecS-S/SCBM
- Laboratoire de Biophotonique et Pharmacologie, Université de Strasbourg
- Departement de chimie organique, Faculté de chimie, Taras Shevchenko National University of Kyiv, Ukraine
- AP-HP, Hôpital Européen Georges Pompidou, Service de Biochimie, Paris
- Lip(Sys)2, Athérosclérose: homéostasie et trafic du cholestérol des macrophages, Châtenay-Malabry
- Laboratoire Chrono Environnement, Université de Bourgogne Franche-Comté, Besançon